検体提出方法
病理検体の提出方法
【病理検体固定法】
- 検体は新鮮な状態で固定
組織の自己融解や乾燥を防ぐため固定はできるだけ早く新鮮な状態で行ってください。 - 固定液は10~20%ホルマリン水溶液
固定液は10~20%ホルマリン水溶液を用い組織の10倍くらいの量を使用し、大きめの容器に組織を入れてください。(シャーレ等は使用しないでください。) - 手術材料について
胃や腸等の手術材料は所定の方法により切り開き、コルク板や薄い板に粘膜面を上にして虫ピン等で留めてから固定液に入れてください。 - 大きい臓器について
子宮や、大きい臓器等は、固定が不十分となることが多いので予め割を入れてから固定してください。
【提出時のご注意】
- 検体と検査依頼書は同時に提出
検査依頼書は必ず所定のものを使用してください。 - 検査依頼書には必要事項を必ず明記
検査依頼書には患者名、性別、年齢、臨床診断、臨床経過および手術、所見等を必ず正確に明記してください。記入漏れ等がありますと検査保留となる場合がありますのでご注意ください。 - 検査依頼書の検査材料、検査項目は必ずチェックを
検査依頼書の検査材料や検査項目の欄には、該当する項目に必ず点等の印をつけてください。 - 乾燥した組織や、結石・虫体等は病理診断の対象となりませんので、ご注意ください。
- 解剖材料並びに死亡後に採取した材料の診断は実施しておりません。ご了承ください。
- 胎児は、標本作製いたしませんので、あらかじめご了承ください。
- 提出容器ラベルへ必要事項の記入
容器に貼ってあるラベルに氏名、年齢、性別および病院名を正確に記入してください。
免疫組織化学染色の提出方法
【提出方法】
所定の検査依頼書に、臨床診断、臨床経過および病理診断が判明しているものについては、診断名を記入してください。
●検査材料
原則として、ホルマリン固定材料の検体に限りますが、未染スライドやパラフィンブロックの提出でも受け付けます。
未染スライド送付の場合、各染色用に3枚ずつ送付してください。(精度管理上必要なため)
※ご注意 未染スライドがH&E染色用(1枚)、陰性コントロール用(1枚)および染色項目枚数分あれば染色は行いますが、はがれ等による再染色となる場合、追加未染スライドおよびブロックの送付等をお願いする場合があります。その際は通常よりも報告が遅れることとなりますので予めご了承ください。
●塗抹スライドでの受付
塗抹スライドからのご依頼の場合は、別途ご相談ください。
●病理診断が必要な場合
固定材料又は、パラフィンブロックのいずれかを提出してください。
●依頼方法
病理組織検査の検査依頼書を使用し抗体名、診断および診断・判定・染色のみから必要事項を記入してください。
精度管理上必要なため、染色のみの依頼でも臨床診断および所見欄を必ず記入してください。
【パラフィンブロック材料】
●材料固定
提出した組織の細胞の自己融解(autolysis)や抗原性を失うことなく、抗原の非働化(immobilization)をいち早く行うために、採取された組織は可能な限りすばやく、固定液(通常10~20%ホルマリン)に入れてください。その際、大きな組織は適当な割を入れて、固定液が早く浸透するようにしてください。(リンパ節は極力、割を入れて固定してください。)固定不良の組織は、病理診断に大きな影響を及ぼすばかりでなく、酵素抗体法による免疫染色においても、染色結果の判定にも重大な誤診を招くことがありますのでご注意ください。
【パラフィンブロックのスライド】
●スライドはシランコーティングスライドを使用してください。
●スライドは十分乾燥させ通常のH&E染色の場合のようにパラフィンを融解した状態で提出してください。
●スライドの場合には、染色中に切片がはがれたりする場合がありますので、指定枚数分提出するようにしてください。(各項目につき3枚)
【スライドでのご提出時の注意点】
病理検査における酵素抗体法では、近年染色性を良好にするため前処理として賦活法が行われるようになり、抗体によっては賦活時に加熟したり界面活性剤を使用することが必須になっています。しかしながら、賦活化は組織にダメージを与えスライドからの切片剥離等の原因になっております。未染標本作製時にはぜひ下記の点にご注意いただき、標本を作製くださるようご協力お願い申し上げます。
- スライドガラスは有効期限内のものをご使用ください。
シランスライドは約3ケ月、ニューシランスライドは約2ケ月でコーティング剤の効果はなくなります。 - スライドガラスはシラン(又はニューシラン)コーティングスライドをご使用ください。
同等のコーティング剤強度があれば他のスライドをご使用くださっても構いません。 - スライドへの貼り付けは50℃で行ってください。
伸展器等を使い、50℃で最低1時間は貼り付けを行ってください。(気泡・シワ等にご注意ください。)その後、60℃でパラフィンを溶かしてください。
新鮮凍結組織の提出方法
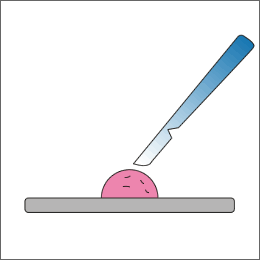
新鮮な組織より切り出します。
(10×10×5mm以下)
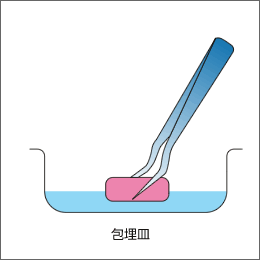
包埋皿に包埋剤(OCTコンパウンド)を2~3ml入れておき、採取した組織を包埋皿に埋め込みます。この時、標本にしたい組織の面は下にして包埋皿においてください。さらにOCTコンパウンドを一杯まで入れてください。
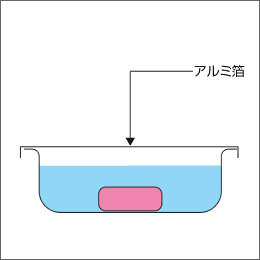 包埋皿の上部をアルミ箔でOCTコンパウンドがこぼれないように覆ってください。
包埋皿の上部をアルミ箔でOCTコンパウンドがこぼれないように覆ってください。
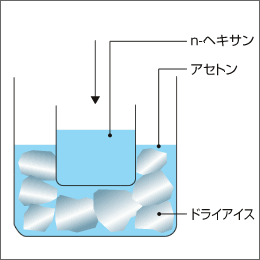 予めアセトン中にドライアイスを入れその容器の中にn-ヘキサンを入れたビーカーを入れて、20分位放置してください。この時n-ヘキサンの中へアセトンが入らないように注意してください。(n-ヘキサンは-70℃位になります。)
予めアセトン中にドライアイスを入れその容器の中にn-ヘキサンを入れたビーカーを入れて、20分位放置してください。この時n-ヘキサンの中へアセトンが入らないように注意してください。(n-ヘキサンは-70℃位になります。)
 包埋皿をn-ヘキサンの中へ入れ1~3分放置してください。
包埋皿をn-ヘキサンの中へ入れ1~3分放置してください。
包埋皿を取り出し、-70℃で保存してください。検体輸送時は必ずドライアイスで行ってください。
※組織は未固定、凍結のものに限ります。包埋皿OCTコンパウンドのみご用意できますので1週間前には連絡をしてください。
※ご注意:組織を包埋剤を用いずに、直に凍結させた場合やすみやかに凍結しなかった場合、組織の形態の破壊・抗原の移動や失活をする恐れがあります。そのため、指定する提出方法以外で提出された場合は十分に染色されないことがありますので、その際は予めご了承願います。
HER2タンパク免疫組織染色の提出方法
1. 固定法
原則として10%中性緩衝ホルマリン固定液で固定してください。固定液に浸漬する時間は24~48時間以内が望ましいです。(固定時間が長い場合や短い場合、染色結果に影響する場合があります。)3日以上固定した症例に関しては、染色結果への影響が考えられます。又、アルコール系の固定液や他の固定液ではHER2タンパク過剰発現の検出および判定には適しません。
2. 材料
適用は10%中性緩衝ホルマリン固定材料およびそのパラフィン包埋された手術材料組織標本のみで、凍結組織および細胞診標本は使用できません。原則として10%中性緩衝ホルマリン固定材料およびブロックでの受託となりますがスライドにて提出される場合には切片の厚さ4~5μmで薄切し、シランコーティングスライドにて提出していただけるようお願いいたします。
未染スライドがH&E染色用(1枚)および染色項目枚数分あれば染色は行いますが、はがれ等による再染色となる場合、追加未染スライドおよびブロックの送付等をお願いする場合があります。その際は通常よりも報告が遅れることとなりますので予めご了承ください。
